固态发酵“五三”理论的分子生物学解读
摘要:中国酿酒大师李家民在“五三”理论中描述固态发酵微生物从菌种到种群再到群落的生态演替过程。美国国家科学院院士邦尼的“群体感应”(Quorum sensing)理论揭示每个细菌都会释放特异性活性信号分子,与同类或者另外的微生物进行自发地相互沟通。由群体感应控制的过程在由单个细菌进行时是无效率的,而在由群体进行时才有效。这与“五三”理论关于微生物的浓度变化规律不谋而合,从分子生物学的角度解释了固态发酵的微生物规律,对食品及生物工业中的固态发酵研究具有深远的积极促进作用。
Li Jiamin, a Chinese brewing master, described the ecological succession process of solid-state fermentation microorganisms from strains to populations to communities in the "five rules and three levels" theory. The "quorum sensing" theory of the National Academy of Sciences Bonnie's "quorum sensing" theory revealed that each bacterium releases specific active signal molecules and spontaneously communicates with the same or other microorganisms. Processes controlled by quorum are inefficient when performed by a single bacterium, but are effective when performed by a quorum. This coincides with the " five rules and three levels" theory on the law of concentration change of microorganisms, which explains the law of microorganisms in solid-state fermentation from the perspective of molecular biology and has a far reaching positive effect on the research of solid state fermentation in food and biological industries.
关键词:固态发酵,微生物,“五三”理论,群体感应,大健康
Key words: solid state fermentation, microorganism, five rules and three levels, quorum sensing, great healthcare
一、固态发酵的“五三”理论
李家民大师在多年的固态发酵实践及理论研究中总结出了固态发酵的五法则三层次,即“五三”理论,并在其主编的《固态发酵》著作中对其做出了深入描述。其主要点是:
1、各类微生物在发酵过程中,经历从菌种到种群再到群落的生态演替过程;
2、微生物所处环境中的物系—菌系—酶系相互作用影响或相互关联,处于不断变化的动态平衡中;
3、固态发酵中固—液—气三相协同作用,三相的比例及转化程度直接影响到发酵质量;
4、自然封闭状态下,整个微生物体系要经历从好氧→微氧→厌氧的代谢环境;
5、体系温度变化表现为前缓—中挺—后缓落的共同特征。
该理论在白酒领域得到了专家学者及从业人员的高度认可,并被广泛地应用。在其它食品发酵领域也有众多的技术人员在学习和研究该理论。
二、群体感应
美国分子生物学家邦尼·林恩·巴斯勒(Bonnie Lynn Bassler)研究发现细菌之间有信息交流机制,并因此于2006年当选为美国国家科学院院士。群体感应系统是一种微生物细胞-细胞之间的通讯机制,是近年来微生物学领域的重大发现之一。从观察到个别微生物种群与细胞密度相关的自我诱导现象开始,到明确群体感应是微生物界广泛存在的重要的细胞-细胞之间的通讯调控系统和相关系列应用研究,其研究经历了偶然发现、范围扩大、理论升华和应用转化的过程。群体感应系统在微生物界普遍存在的证明,不仅为明确病原菌致病调控机理、阐明微生物生态竞争和动态平衡机制提供了一个全新的切入点,同时也为调控微生物生态体系和发展新的病害防控策略等奠定了坚实的基础。
细菌感染不会自动导致疾病;许多细菌只有在大量出现时才变得危险。在一项新的研究中,来自德国马克斯普朗克感染生物学研究所等研究机构的研究人员发现宿主细胞具有一种受体,它不能识别细菌本身,但可以侦察细菌之间的通讯。当有大量细菌存在时,宿主就会使用这种受体来记录它们分泌的称为毒力因子的致病性物质。通过这种群体感应机制,宿主细胞能够在需要抵御这种细菌攻击的时候激活免疫系统。
群体感应是微生物之间的沟通“语言”,那么微生物分泌的各种信号分子便是其语言体系的化学成分“语种”。目前,已发现了微生物王国的三个大“语种”,分别是介导革兰氏阳性菌群体感应的寡肽、介导革兰氏阴性菌群体感应的酰基高丝氨酸内酯和能同时介导革兰氏阳性菌与革兰氏阴性菌群体感应的自诱导物-2。当然,也存在一些小“语种”,如γ-丁内酯、二酮哌嗪类化合物、喹诺酮等。
例如铜绿假单胞菌(Pseudomonas aeruginosa),它就是这样的一种细菌。人们经常会接触到它,这是因为它主要存在于水管、洗手盆和其他类似的地方。但是,铜绿假单胞菌大量滋生后会导致严重的疾病。它们通过形成致病性物质来做到这一点,这就使它们能够在宿主中站稳脚跟并造成损害。这种细菌很容易引起肺炎、伤口感染或菌血症和血液中毒,尤其是在医院患者中。鉴于这种细菌对抗生素具有高度抵抗力,这些疾病极难治疗。
三、微生物与动植物的依赖关系
John Donne曾讲过“人是社会性动物,没有人能脱离社会群体而单独存在”。这句话又何尝不是对微生物群体感应的最好诠释?可以说,微生物王国的“语言”——群体感应(Quorum sensing)的发现是近20年微生物研究领域中最重大的进展之一!随着研究的深入,相信我们一定能从微生物的“语言”中解读出更多重要信息,给因微生物病害而蒙受巨大痛苦和损失的人们带来福音!
自然环境中,植物与多样化的微生物相互接触且以各种复杂的方式相互作用。尽管为了更好地了解植物的防御病害机制而对植物与病原菌的相互作用进行过密集的研究,然而许多微生物及微生物组对他们的宿主有很多实质性的益处。这些益处包括促进营养的吸收、加速植物生长、增强抗逆性,提高对非生物逆境胁迫(热、干旱、盐)的抵抗力。然而,细菌菌株或它们的组合对宿主的有益影响通常是品种及物种特异性的,这就为大范围使用造成了困难。值得注意的是许多激发植物免疫反应的信号在分子水平上高度相似且在病原菌或有益菌中常常是相同的。
微生物对各种信号分子的识别便是其“语言体系”的“语法”。“语种”不同,则“语法”也存在差异。酰基高丝氨酸内酯能自由扩散到微生物细胞内,与胞内相应的受体结合,从而激活或抑制靶基因的表达;寡肽和自诱导物-2均不能扩散到微生物细胞内,它们需要借助膜结合的双组分信号转导系统才能将信号传到胞内,最终激活或抑制靶基因的表达。目前的研究表明,受群体感应调控的基因在致病微生物成功在宿主内定植、发动“攻击”的过程中发挥了极其重要的作用。
“魔高一尺,道高一丈”,微生物能利用群体感应给人类健康、动物生产造成危害,人类则在掌握了微生物的“语言”后,能采用各种手段对其群体感应过程进行干扰,通过阻断微生物的交流、使群体中微生物个体都成为“聋哑”个体,从而实现抗微生物病害,做到“以其人之道还治其人之身”。
如下图所示,宿主细胞的芳香烃受体应该可以根据细菌表达的信号分子的水平,监测细菌感染和疾病的进程,从而针对感染的不同阶段,精心安排最合适的免疫反应。体外和体内实验一致表明,细菌产生的群体感应信号分子,在细菌群体生长的不同阶段,会差异性的调节芳香烃受体。即,芳香烃受体会根据周围群体感应信号分子水平的变化,定量地检测细菌感染的过程,调整免疫防御策略。
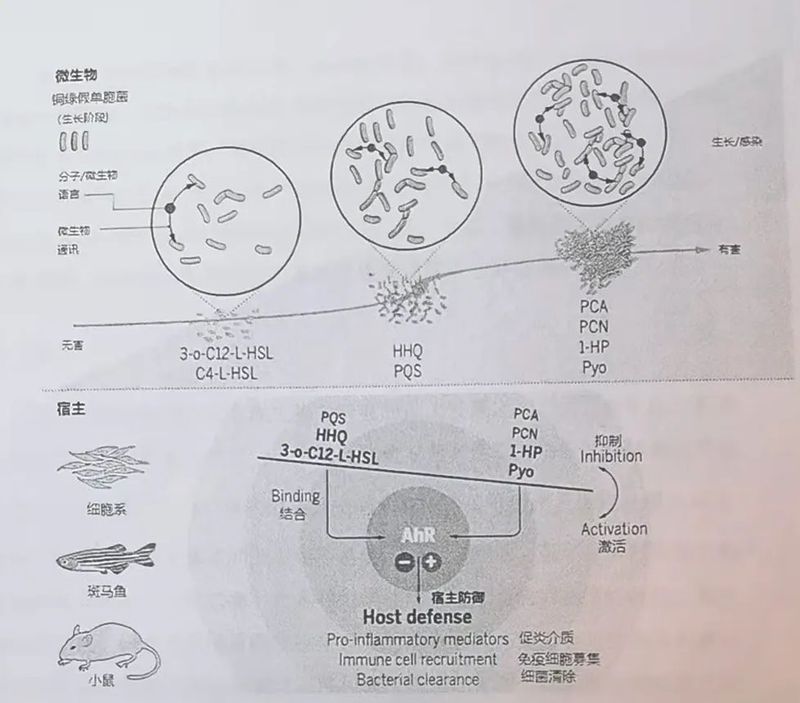
AhR在防御细菌感染中的动态作用
AhR侦查细菌通讯,并将细菌信号传导词汇转化为最合适的宿主防御系统。细菌群体感应分子(例如高丝氨酸内酯,喹诺酮和吩嗪)的表达根据局域密度和感染状态而变化。AhR可以检测群体感应分子的类型和数量,从而检测感染状态,从而调整宿主防御能力。
四、微生物与健康
在过去的二十年里,我们看到了在肠道微生物群和宿主之间的动态相互作用的研究快速增长。从快速发育的新生儿到成人,许多科学家研究了肠道-宿主串扰对宿主健康的影响,并确定了肠道微生物群在宿主广泛年龄范围内观察到的许多病理学中的作用。了解促进健康的微生物群是如何建立的,以及它们与宿主的有益互动是至关重要的生物医学。然而,我们对特定的微生物群落成员以及负责这些相互作用机制的代谢和宿主基因调控途径的了解还处于初级阶段。因此,实现肠道微生物群治疗潜力的能力受到了阻碍。
新生儿肠道最初缺乏微生物,逐渐被细菌、真核生物、古细菌和病毒的复杂集合所定植。这种多样的微生物系统通常被称为肠道微生物群。肠道微生物群可显著影响宿主生理,例如获取和提供营养或调节免疫系统。人们对这个复杂生态系统的兴趣可以追溯到20世纪初梅奇尼科夫的工作。Metchnikoff感兴趣的问题仍然是相关的今天,例如,肠道微生物群如何可能有害健康,以及如何可以通过管理促进健康的细菌来补救这一问题。
五、结论
微生物群体感应系统是微生物学研究的重大发现之一,但目前仅在少数模式细菌中有较为系统的研究。很多微生物病原尤其是真菌病原的群体感应系统和寄主-病原跨界通讯系统的信号分子尚未鉴定,信号通路及调控机理也尚未查明,微生物与前噬菌体的关系也不甚明了。可以预见,在小分子分离鉴定和蛋白结构分析技术日益成熟、在各种组学技术飞速发展的后基因组时代,微生物通讯系统的研究将继续是微生物学研究的重中之重,交叉学科协同攻关将有利于阐明微生物基因表达的调控网络和调控机理、有利于揭示微生物彼此之间互作竞争的作用机制、有利于明确寄主和环境因素影响相关基因表达的分子机理。这些研究成果也将有效地扩展和丰富我们设计绿色安全病害防控措施的思维与视野。
今后的研究重点将有如下方面:
1)以细菌和真菌群体感应通讯系统以及病原-寄主跨界通讯系统的重大科学问题为核心进行研究,有助于全方位建立微生物群体感应通讯系统创新研究的科学体系,有助于创建微生物群体感应通讯系统调控的新理论、新思路与新方法,有助于丰富和发展微生物学科的相关基础理论和技术,有助于人类肠道微生物与健康之间的深入研究。
2)以微生物群体感应通讯系统领域的科学前沿为突破口,将可加深人们对病原微生物和生防微生物目标性状与基因调控机理的认识,揭示群体感应通讯系统在病原-寄主互作过程中的功能与生物学基础,促进微生物学与植物保护学、遗传学等其他学科的交叉渗透和共同发展。
3)群体感应、跨界通讯和群体淬灭的知识创新,将为病害防控提出新思路和新措施,为减少农(兽)药的使用、发展新型绿色安全环保农(兽)药和实现微生物制剂的更新换代提供关键的理论基础和技术支撑,为防控人类微生物病害、克服微生物抗药性问题提供有益的借鉴。
综上所述,固态发酵的“五三”理论是中国酿酒及食品发酵的经验总结及规律发现。微生物群体感应通讯系统研究能够从分子生物学的层面佐证其理论。群体感应揭示影响微生物重要生命过程的调控网络、能够为设计绿色安全病害防控制剂提供关键的理论基础和新型靶标。值得研究的是,群体感应通讯系统不仅参与微生物致病基因的表达调控,而且也直接影响微生物的抗药性及其与动植物宿主之间的关系。因此,深入开展微生物之间的信息交流以及病原菌与寄主间的信息通讯系统研究可望取得原创性的重大突破,对人类大健康事业及食品安全等与人类密切相关的领域具有重大的科学意义和应用价值。
参考文献
[1].李家民.固态发酵[M].成都:四川大学出版社,ISBN:9787569004519.
[2].维基百科群体感应[OL].
https://en.wikipedia.org/wiki/Bonnie_Bassler.
[3].张炼辉.微生物群体感应系统的研究进展[J].华南农业大学学报,2019,40(5):50-58.
[4].Pedro Moura-Alves Host monitoring of quorum sensing during Pseudomonas aeruginosa infection[OL].
https://science.sciencemag.org/content/366/6472/eaaw1629
[5].Patricia A. Rodriguez Systems Biology of Plant-Microbiome Interactions Molecular Plant[OL].
https://doi.org/10.1016/j.molp.2019.05.006
[6].亚热带农业生态研究所微生物王国的语言—群体感应[OL].
http://www.cas.cn/kxcb/kpwz/201210/t20121028_3667930.shtml#
[7].Kostic AD, Gevers D, Siljander H, et al. The dynamics of the human infant gut microbiome in development and in progression toward type 1 diabetes.Cell Host Microbe.2015;17:260-273. [OL].
https://doi.org/10.1016/j.chom.2015.01.001.
[8].Oliphant K, Parreira VR, Cochrane K,Allen-Vercoe E. Drivers of human gut microbial community assembly: coadaptation,determinism and stochasticity. ISME J.2019:13:3080-3092. [OL].
https:// doi.org/10.1038/s41396-019-0498-5.
[9].Stewart CJ,Ajami NJ. O’Brien JL, et al. Temporal development of the gut microbiome in early childhood from the TEDDY study.Nature,2018;562:583-588. [OL].
https://doi.org/10.1038/s4158 6-018-0617-x.
[10].Lampe JW, Kim E, Levy L, et al. Colonic mucosal and exfoliome transcriptomic profling and fecal microbiome response to a faxseed lignan extract intervention in humans. Am J clin Nutr. 2019;110:377-390[OL].
https://doi.org/10.1093/ajcn/nqy325.
[11].Hooper LV, Midtvedt T, Gordon JI. How host-microbial interactions shape the nutrient environment of the mammalian intestine.Annu Rev Nutr. 2002;22:283-307.6.Marchix J,Goddard G, Helmrath MA. Host- gut microbiota crosstalk in intestinal adaptation.Cell Mol Gastroenterol Hepatol.2018;6:149-162.[OL].
https://doi.org/10.1016/j.jcmgh.2018.01.024.
[12].Knight R. Follow your gut: the enormous impact of tiny microbes. New York: Simon & Schuster/TED; 2015.8.Mackowiak PA. Recycling Metchnikof: probiotics, the intestinal microbiome and the quest for long life. Front Public Health.2013;13:52[OL].
https://doi.org/10.3389/fpubh.2013.00052.
[13].Ivan Ivanov Gut-host Crosstalk: Methodological and omputational Challenges[OL].
https://link.springer.com/article/10.1007/s10620-020-06105-9.
作者简介© 王益,正高级工程师,曾于天府英才中心从事分子生物研究。 |
- END -
来源于公众号-李家民工作室,本文略有删改。
